两栖动物变态发育
作者:刘露莎
1. 两栖动物变态发育的形态变化
两栖动物是脊椎动物由水生生活到陆生生活转变的过渡类群,大部分物种需要经变态发育才能登陆。从水栖幼体变态发育至陆栖成体,两栖动物的各个组织和器官都需要经历重构以适应新的生态位(Just et al., 1981)(图1)。这个过程中主要发生了以下三方面的改变:1)蝌蚪特异性的组织器官被完全吸收,尾巴和鳍褶发生凋亡吸收;角质凿和角质颚脱落,嘴的形态变化;泄殖腔变短退化;鳃凋亡消失;2)成体特异性组织器官发育分化,四肢发育分化,眼从头的背部突出并长出眼睑,舌从嘴的底部长出;3)变态前后都存在并具有功能的组织器官发生重构,皮肤、肠道、肝脏、脑和背部骨骼肌相关的幼体型细胞凋亡,成体型细胞增殖分化(Shi, 2000)。这些组织形态的转变使其食性及摄食方式、呼吸方式、运动方式及代谢方式发生了改变,从而得以适应陆生环境。
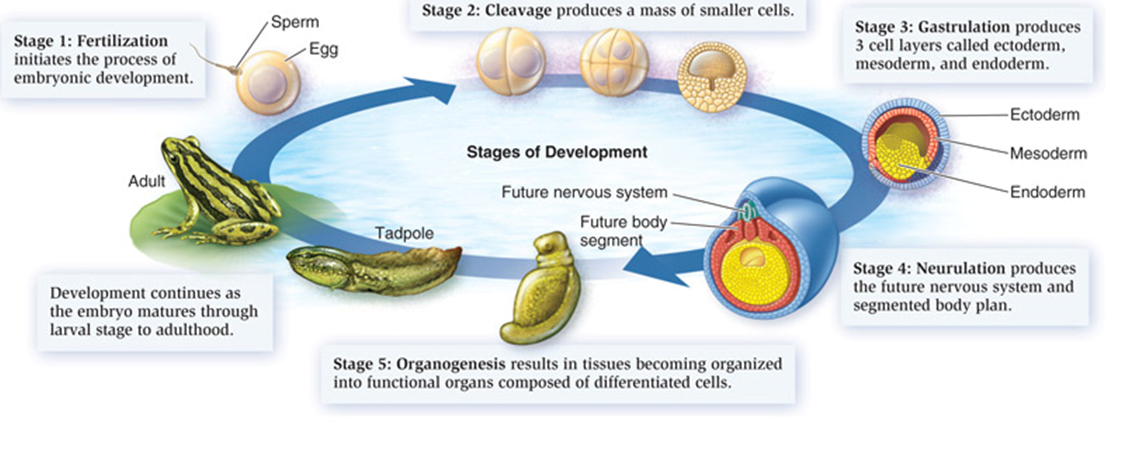
图1. 两栖动物发育过程(Gilbert, 2010)
2. 两栖动物变态发育的调控-激素水平
Gudernatsch(1912)发现绵羊的甲状腺干粉喂小蝌蚪能促使其提早进行变态,而蝌蚪的甲状腺被摘除后变态发育不再发生(Allen, 1925),揭示了甲状腺在变态发育中的关键作用。Harington et al.(1927)从甲状腺中分离出了甲状腺素(thyroxine,T4),揭示了甲状腺激素(TH)是调控变态发育的有效成分。无尾目的变态发育可以分为四个阶段:变态发育早期、变态发育前期、变态发育高峰期和变态完成期。变态发育早期是指胚胎和蝌蚪在甲状腺激素未分泌时的生长发育,这个阶段后肢仅发生较为有限的改变;在变态发育前期,随着TH浓度的累积升高,后肢趾头开始分化生长;而到了变态发育高峰期,TH的浓度上升到整个变态过程的最高,快速的形态变化在这个阶段发生;而到了变态发育完成期,TH水平明显下降(Sachs, 2000)(图2)。TH的产量由神经中枢系统控制,下丘脑通过感知内外环境来调节激素,神经激素通过下丘脑控制激素的合成和分泌,下丘脑分泌的激素刺激垂体,垂体前叶和肾间质腺体调节促甲状腺素的量来刺激甲状腺分泌TH,从而调节靶细胞的活性来调节变态速度(图3)。在蝌蚪期,脑垂体也通过分泌催乳素(prolactin)与甲状腺拮抗,刺激生长,延迟变态(Denver et al., 2013)。
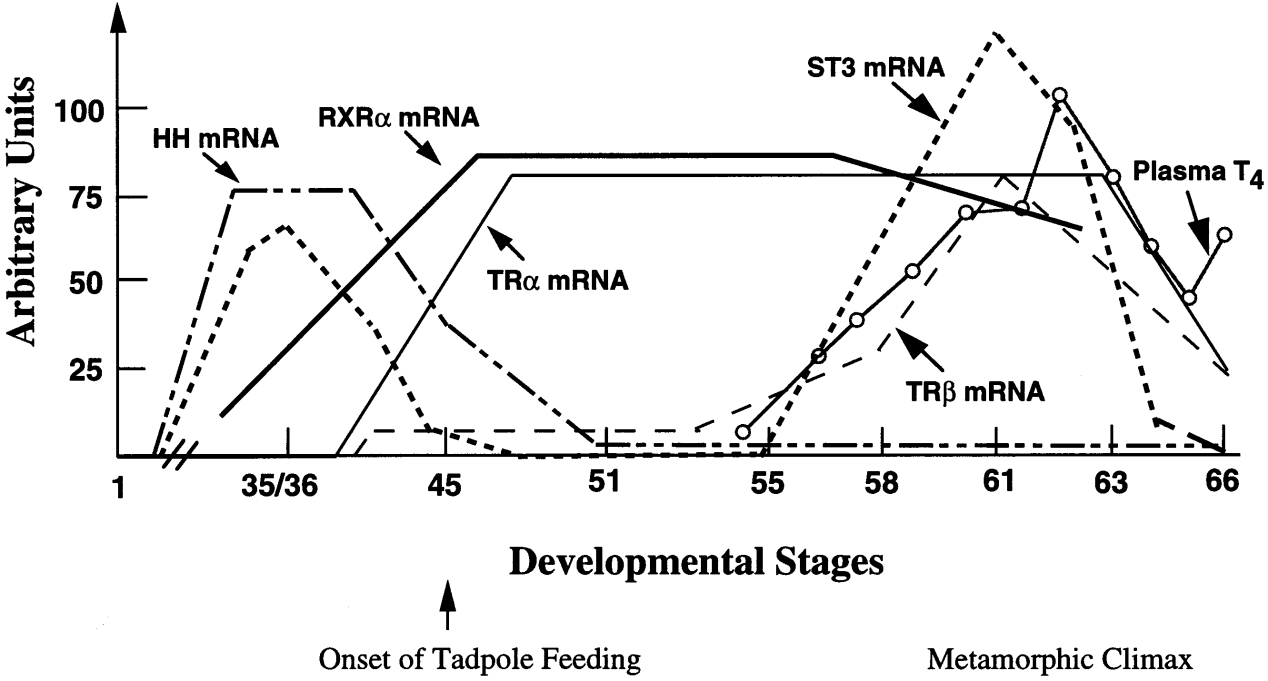
图2. 变态发育中甲状腺激素及相关基因变化情况(Sachs et al., 2000)
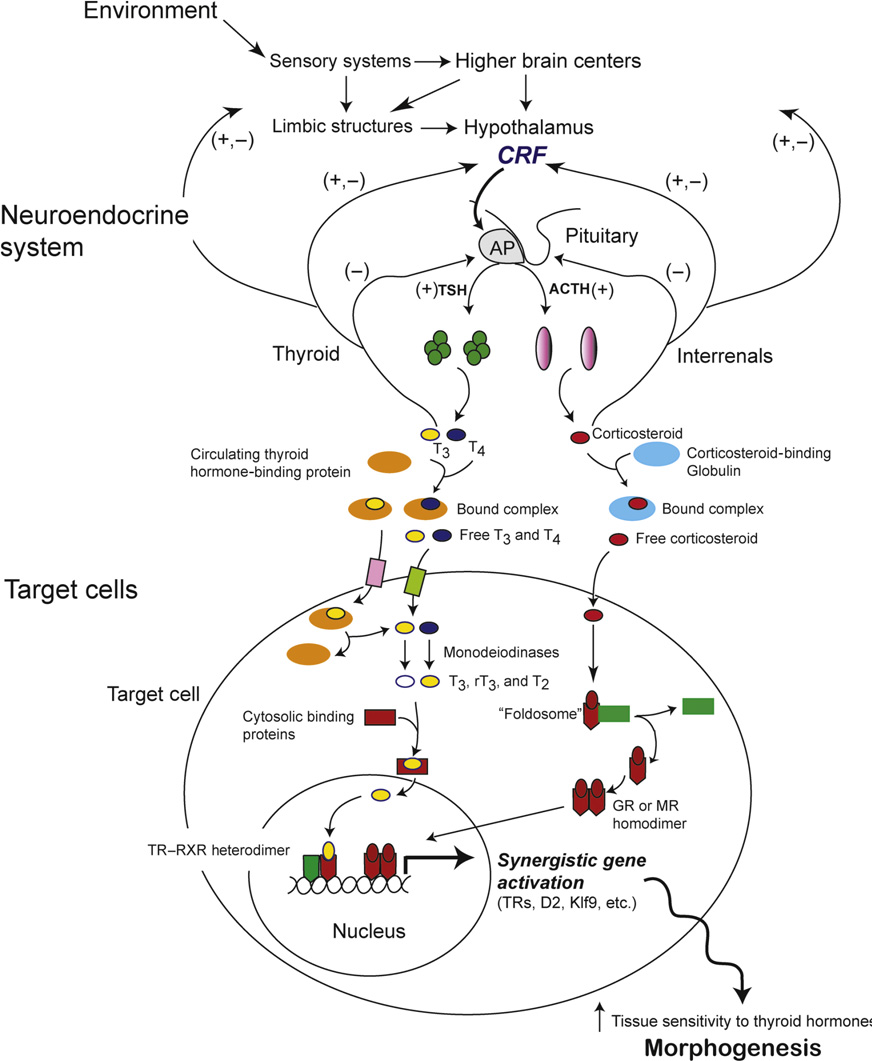
图3. 甲状腺内分泌轴调控两栖动物的变态发育(Denver et al., 2013)
3. 两栖动物变态发育的调控-基因水平
变态发育在分子水平上是通过核受体的转录调节作用发生的,TH的功能只有在结合核受体时才能起作用。在变态发育早期,未结合TH的甲状腺激素受体(TRα)通过招募染色质调控因子(如:N-CoR和SMRT等)到特定区域,使得组蛋白去乙酰化(Sachs, 2000),协同抑制变态发育相关下游基因的激活(Buchholz et al., 2003; Sato et al., 2007);而变态发育期,甲状腺分泌TH,TH与TRα结合改变TRα的构象,从而招募染色质调控因子(如:SRC-1,CBP/ P300及P/CAF等)到特定区域,使得组蛋白乙酰化,协同激活变态发育下游相关基因,开启变态发育过程(Grimaldi et al., 2013)(图4)。在目标组织器官的细胞核中,TH与受体结合后激活或抑制基因的表达,随后诱导下游基因表达并决定细胞命运,最终导致组织特异性的形态发生。
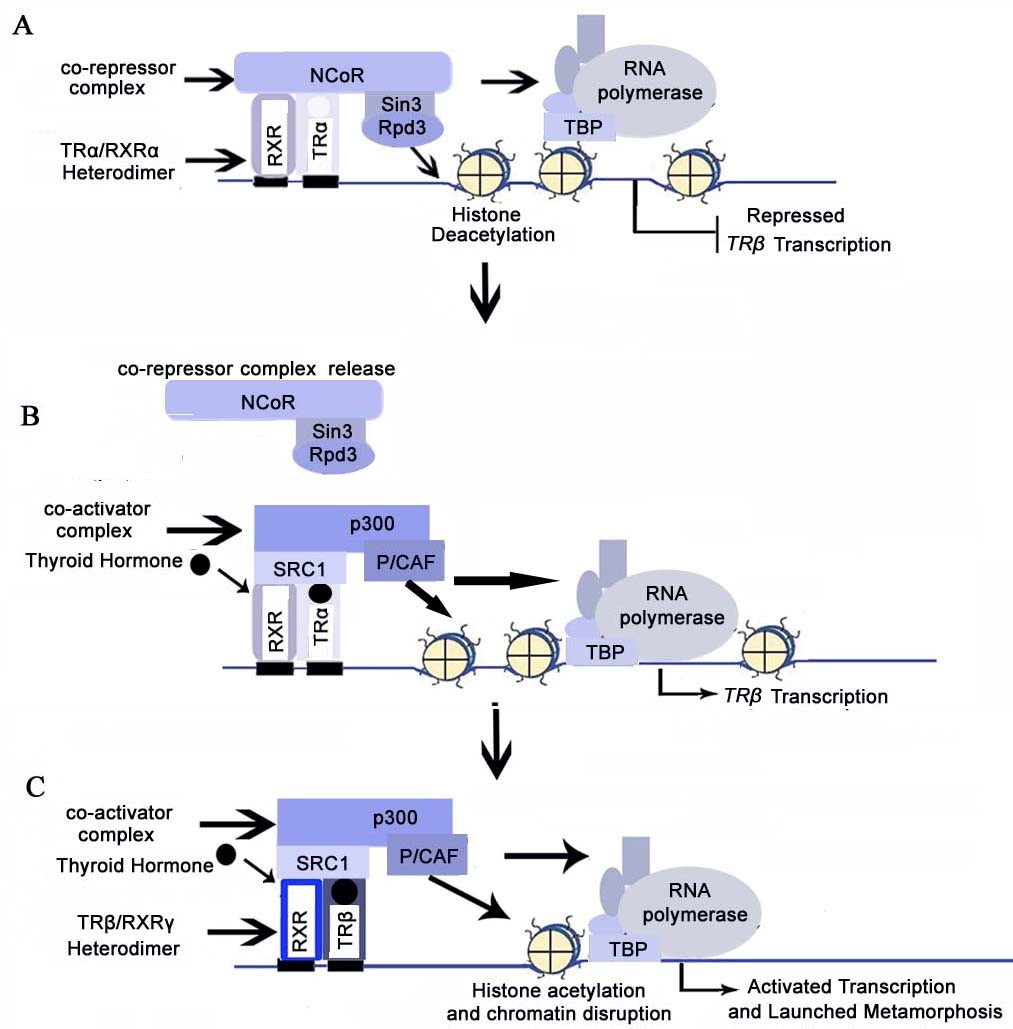
图4. 两栖动物变态发育的分子机制模型(Buchholz et al., 2006)
4. 两栖动物变态发育的调控-miRNA水平
对变态发育的调控除了激素水平、转录因子水平外,miRNA也发挥着重要的作用。miRNA是一类长度约19-25 nt的内源性非编码小分子RNA,其通过碱基互补配对的方式结合在靶基因的3’UTR引起靶基因mRNA降解或者翻译受阻,从而在转录后水平上参与基因的表达调控,进而在胚胎发育、胚后发育、组织分化、细胞增殖和凋亡等生物学过程中发挥重要的作用。
中国科学院成都生物研究所江建平课题组以变态发育快、变态过程身体透明及变态发育后陆生的饰纹姬蛙为研究对象,首次系统性的揭示miRNA在无尾两栖动物变态发育中的调控作用。该研究共获得了属于82个miRNA家族的164条保守的饰纹姬蛙miRNA,同时预测了36个新的miRNA,其中20个已知的保守miRNA和1个新预测的miRNA在变态前后显著性差异表达,这些miRNA在变态发育中都发挥着重要的作用(Liu et al., 2018a)。以饰纹姬蛙转录组unigene为靶基因文库,该研究用miRanda(3.3a)对21个显著差异表达miRNA进行靶基因预测,共预测到10,206个靶基因,对这些基因进行功能富集发现,PI3K-Akt通路被显著富集,说明miRNAs通过调控该通路中基因的表达来调节其变态发育中身体的重构。基于饰纹姬蛙在变态发育过程中mRNA、miRNA的表达及其调控关系,研究还构建了TH通路miRNA-靶基因的调控网络,清晰的展示了miRNA在变态发育过程的调控作用(图5)。
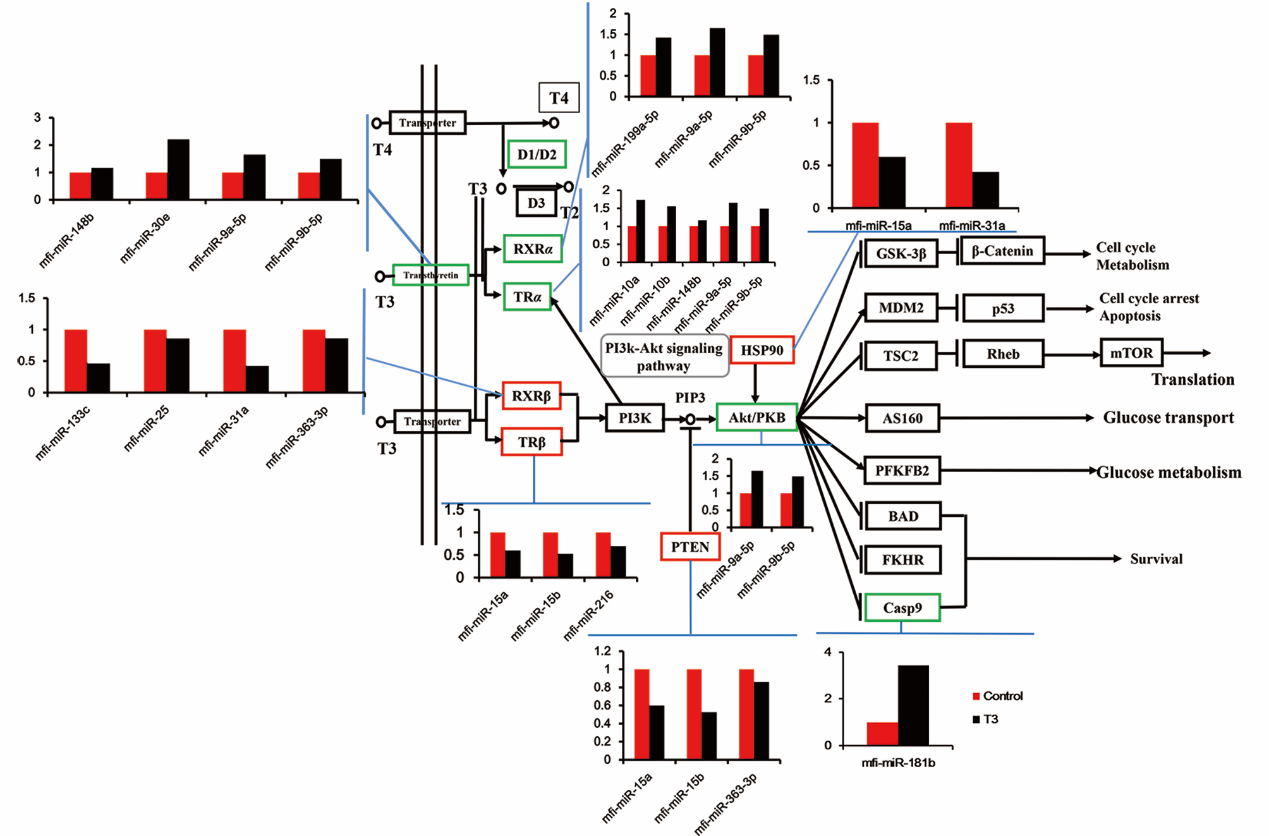
图5. 甲状腺激素通路靶基因-miRNA调控网络 (Liu et al., 2018a)
5. 展望
两栖动物在变态发育过程中存在幼体型器官的凋亡和成体型组织器官的发育分化,因此两栖动物的变态发育可作为研究组织器官发育和凋亡调控机制的良好模型(Liu et al., 2016)。同时,利用两栖动物变态发育对甲状腺激素高度敏感且不受母体影响的特点,可建立甲状腺干扰物两栖动物监测模型,并开展其发育毒性及其分子机制的研究(Liu et al., 2018b)。
参考资料
Buchholz, D.R., Hsia, S.C., Fu, L., Shi, Y.B. (2003). A dominant-negative thyroid hormone receptor blocks amphibian metamorphosis by retaining corepressors at target genes. Molecular Cell Biology, 23(19), 6750-6758.
Buchholz, D.R., Paul, B.D., Fu, L., Shi, Y.B. (2006). Molecular and developmental analyses of thyroid hormone receptor function in Xenopus laevis, the African clawed frog. General and comparative endocrinology, 145(1), 1-19.
Denver, R.J. (2013). Neuroendocrinology of amphibian metamorphosis. Current Topics in Developmental Biology, 103, 195-227.
Gilbert S.F. (2010). Developmental Biology, Ninth Edition, Sinauer Associates Inc.
Grimaldi, A., Buisine, N., Miller, T., Shi, Y.B., Sachs, L.M. (2013). Mechanisms of thyroid hormone receptor action during development: lessons from amphibian studies. Biochimica et Biophysica Acta, 1830(7), 3882-3892.
Gudernatsch, J. (1912). Feeding experiments on tadpoles. Archiv für Entwicklungsmechanik der Organismen, 35(3), 457-483.
Harington, C. R., Barger, G. (1927). Chemistry of thyroxine: constitution and synthesis of thyroxine. Biochemical Journal, 21(1), 169.
Just, J.J., Kraus-Just, J., Check, D.A. (1981). in Metamorphosis (eds. Etkin, W. et al.), New York, Springer.
Liu L.S., Wang X.G., Zhang M.J., Jiang J.P. (2018b). Identification of thyroid hormone receptors α and β genes and their responsiveness to T3 in Microhyla fissipes. Asian Herpetological Research, 1, 13-23.
Liu L.S., Zhao L.Y., Wang S.H., Jiang J.P. (2016). Research proceedings on amphibian model organisms. Zoological Research, 37(4), 237-245.
Liu L.S., Zhu W., Liu J.Y., Wang S.H., Jiang J.P. (2018a). Identification and differential regulation of microRNAs during thyroid hormone dependent metamorphosis in Microhyla fissipes. BMC Genomics, 19, 507.
Sachs, L. M., Shi, YB. (2000). Targeted chromatin binding and histone acetylation in vivo by thyroid hormone receptor during amphibian development. PNAS, 97(24).
Sato, Y., Buchholz, D.R., Paul, B.D., Shi, Y.B. (2007). A role of unliganded thyroid hormone receptor in postembryonic development in Xenopus laevis. Mechanisms of Development, 124(6), 476-488.
Shi, Y.B. (2000). Amphibian metamorphosis: from morphology to molecular biology. New York, Wiley-Liss.
作者介绍
刘露莎,中国科学院成都生物研究所(Chengdu Institute of Biology, Chinese Academy of Sciences),副研究员,主要研究方向为两栖动物变态发育及骨骼肌发育研究。
审核编辑:高伟、陈宏满






